|
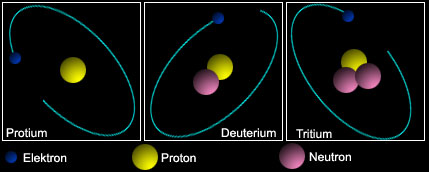
nastavak 1 | 2 Jedinjenja vodonika U jedinjenjima ima sledeće oksidacione brojeve (-1 i +1). Glavne grupe jedinjenja koje gradi vodonik su:
Dobijanje vodonika Za dobijanje vodonika koriste se njegova jedinjenja. U laboratoriji se koristi rastvaranje nekog metala (pr Cink, Zn) u nekoj jakoj kiselini (HCl ili H2SO4). U industriji vodonik se dobija: elektolizom vode, redukcijom vodene pare sa ugljenikom ili sa užarenim gvožđem ili elektrolizom vodenog rastvora NaCl. Voda je slab elektolit pa se zato pri elektrolizi dodaju rastvori alkannih hidroksida. Pritom se na katodi izdvaja vodonik, a na anodi kiseonik.
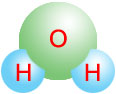
Provođenjem vodene pare kroz užareni koks (ugljenik, C) na temperaturi od 1000°C do 1400°C dobija se smesa vodonika i ugljen-II-oksida (poznatijeg kao ugljen monoksid) koji se zove vodeni gas: H2O(g) + C -> H2(g) + CO(g). Da bi se vodonik odvojio od dobijene smeše, vodeni gas se meša sa vodenom parom i provodi kroz katalizator (obično neki oksid gvožđa) na temperaturi od 450°C. H2O(g) + CO(g) -> H2(g) + CO2(g). Nastali CO2 se rastvara u vodi pod pritiskom ili se apsorbira nekom od baza. Biološki podaci Biološka uloga: Vodonik je sastavni deo DNA i ostalih organskih molekula. Jednako je važan radi toga što je sastavni deo molekula vode koja je osnova života od ćelije pa na više. Svaki oblik života na Zemlji ovisi direktno o vodi. Bez nje život verovatno ne bi bio moguć. Toksičnost: Vodonik nije toksičan, ali je zagušljiv. Opasnosti: Iako nije otrovan, ako se udiše može se zameniti s kiseonikom u plućima i tako prouzrokovati nesvest i smrt. Vrlo je zapaljiv i eksplozivan ako je pomešan sa vazduhom (stvara vodonikov praskavac - H2/O2 2:1). Količina u čoveku
Dnevno potrebna količina: uglavnom kao voda Ukupna masa elementa u 70 kg teškoj (prosječnoj) osobi: 7 kg
Neki hemiski podaci Elektronski afinitet (M -> M-)/kJ mol^-1: 72,8
Minerali i proizvodnja Minerali: Minerala vodonika nema, ali se nalazi u mnogim drugima kao sastavni deo. Izvori: Vodonik se najčešće proizvodi iz prirodnog gasa metana: CH4+2H2O->3H2+CO. Nešto se proizvodi i elektrolizom slane vode. Dobiva se i puštanjem vruće pare preko užarenog koksa. Kao rezultat se dobija H2 i CO. Svetska proizvodnja/m3 godina: 350 x 109 Rezerve: Gotovo beskonačne. Pakiranje (uobičajeno): Maleni kontejneri pod pritiskom. Količine: Vodonik je najrasprostranjeniji element u svemiru, budući da je najlakši element (red. br. 1). Sagara ga gotovo svaka zvezda. 75% onoga što vidite kada pogledate u nebo je vodonik. Deca zvezda Vodonik kao najprostiji element i kao najstariji u kosmosu je osnovna jedinica za gradnju težih elemenata. Taj proces se vrši u jezgrama zvezda gde se vrši nukleo sinteza lakših jezgara u teže. Pod jakim pritiskom (milioni atmosfera) i velikoj temperaturi 4 vodonikova jezgra (protoni) se fuziraju u jedno helijumovo jezgro. U zavisnosti od početne mase zvezde ovaj proces moče da se nastavi sve do sinteze gvožđa (Fe) u jezgru i tu je kraj nukleosintete u jezgrima zveda. Tada dolazi do gravitacionog kolapsa jezgra gde od jezgra nastaju neutronske zvezde ili crne jame (poznatije kao crne rupe). Spoljašnji slojevi zvede u jednoj od najveličenstvenijih eksplozija u svemiru poznate kao supernova se odbacuju u svemir i pri toj eksploziji nastaju svi poznati prirodni elementi. Svaki atom našeg tela ma koji on bio je stvoren u jezgrima zvezda ili u eksploziji supernove. Zato možemo reći da smo svi mi na neki način deca zvezda. (mart 2003.) 1 | 2
|